今回は学校の飲料水の検査について、薬学でも重要な「 遊離残留塩素 」「 結合残留塩素 」について解説します。
また、塩素消費量や塩素要求量、不連続点塩素処理についても確認していきます。
検査項目・内容については文部科学省の『学校環境衛生管理マニュアル』を参照します。
Cf. 学校環境衛生管理マニュアル(文部科学省)
学校の飲料水(水道水)
水道水は、原則として各市町村の水道局が管理・運営しており、厚生労働省で定められている水質基準に基づいて検査が行われます。
児童が普段利用する飲料水は学校の水道水であり直接口に入ることからも、飲料水検査は学校保健上非常に重要なものと言えるでしょう。
学校の飲料水に関する検査対象は3種類に分類されており、
(1) 水道水を水源とする飲料水(専用水道を除く。)
(2) 専用水道に該当しない井戸水等を水源とする飲料水
(3) 専用水道(水道水を水源とする場合を除く。)及び専用水道に該当しない井戸水等を水源とする飲料水の原水
学校環境衛生マニュアル
とされています。
水源や原水の種類によって必要な検査や回数は異なりますが、自然の水を利用する場合には食中毒等のリスクも多分に増加するので、その水質の安全性を担保することは、私たちにとって健康や命を守ることに他なりません。
水道水においては、水をためておく貯水槽がどの高さにあるか(地上にあるか建造物の屋上にあるか)によって、水が届きにくい末端の給水栓が異なり、優先して検査すべき場所も変わってきます。
塩素消毒
水の消毒にはオゾン(O3)や紫外線などが用いられることもありますが、日本の水道では塩素(Cl2)による消毒が行われ、その理由として、
①安価
②消毒効果が大きい
③大量の水の消毒が可能
④残留性が高い
⑤容易に測定可能
などがあります。
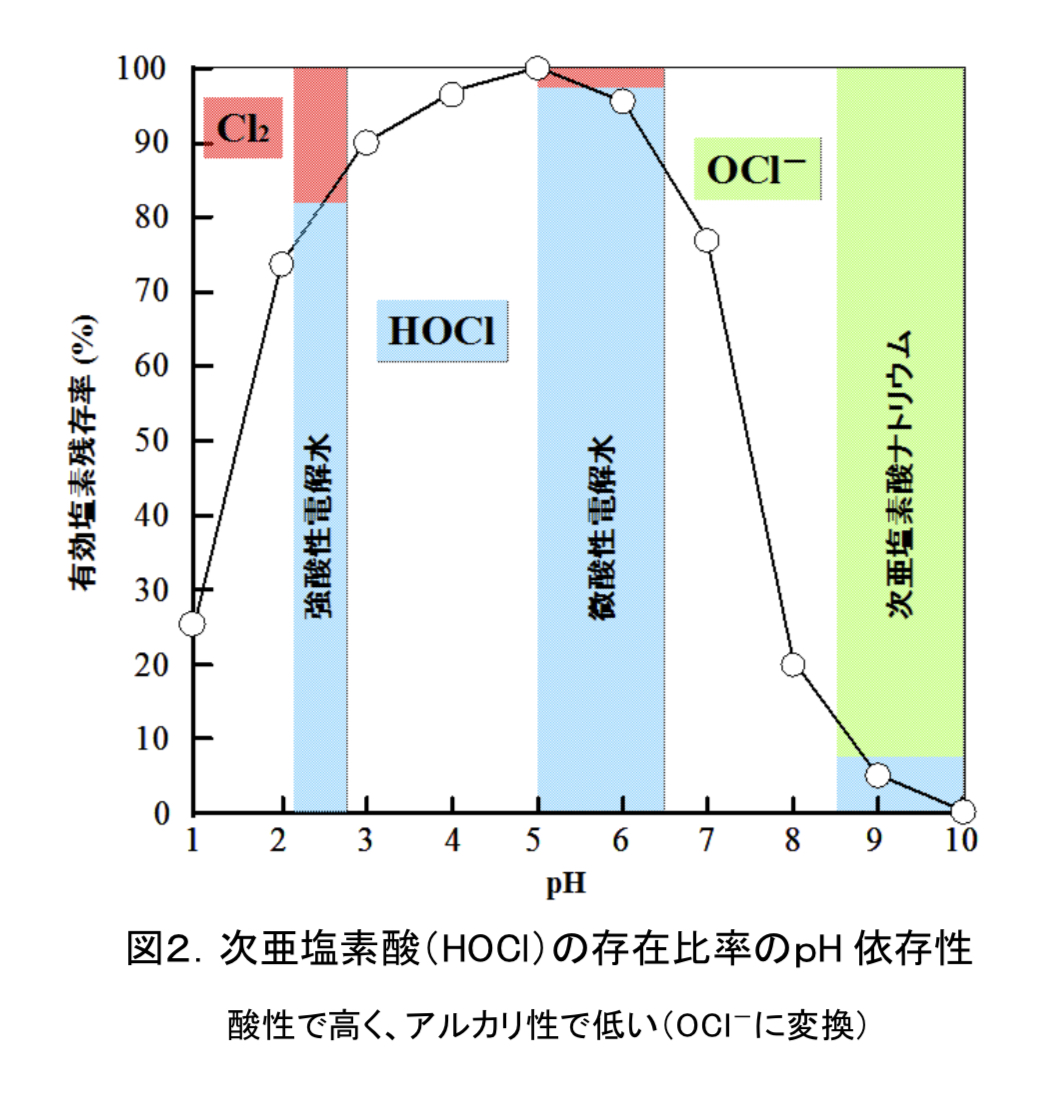
塩素の殺菌作用は、水との反応で生成する次亜塩素酸(HClO)が主体ですが、水溶液のpHによって次亜塩素酸の分子形(HClO)とイオン形(ClO−)の存在比率が異なり、一般的な水道水のpH(5.8〜8.6)ではほとんどが殺菌力の高い分子形(HClO)として存在します。
((★)化学反応式:Cl2 + H2O ⇄ HClO + HCl 、HClO ⇄ H+ + ClO−)
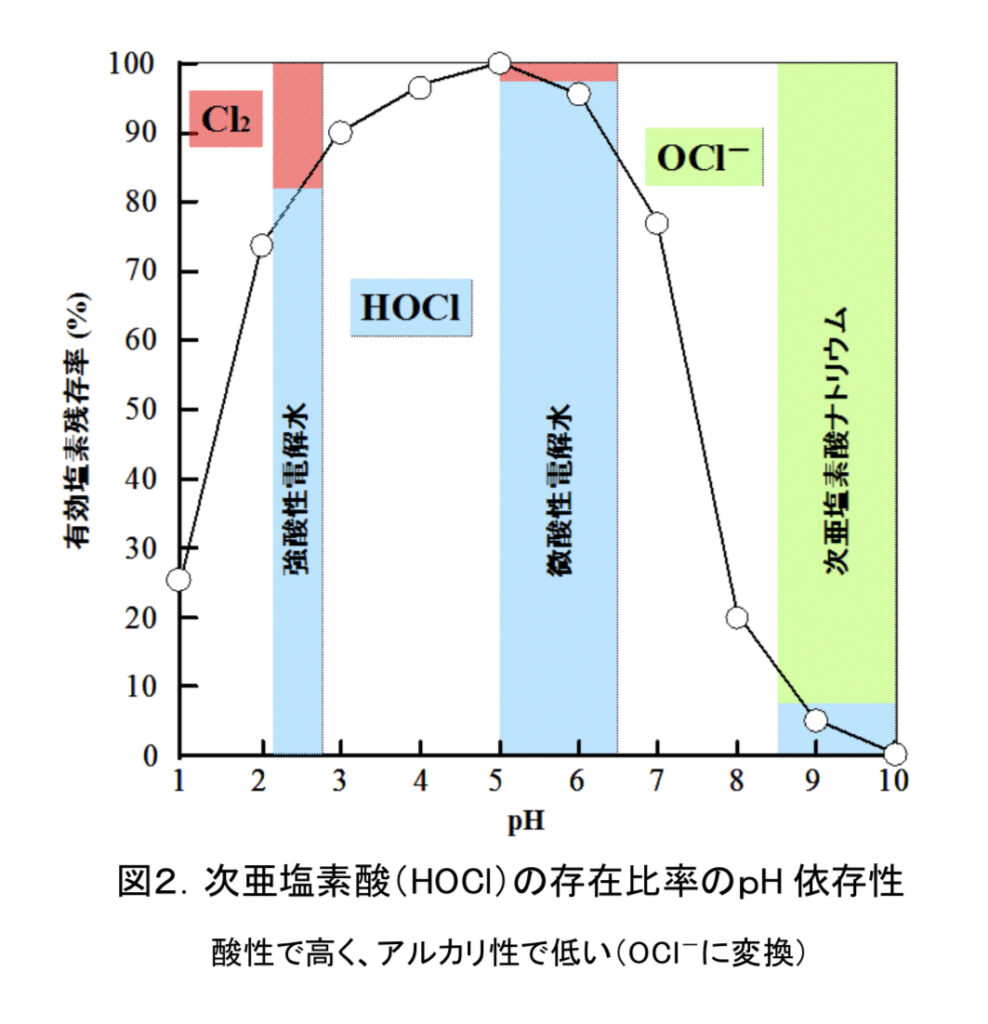
イオン形より分子形の方が殺菌作用が強いのは、脂溶性の高い分子形の方が細菌などの細胞膜の透過性に優れているためで、水溶性の高いイオン形では細胞膜の透過性が分子形に比べ低くなり殺菌作用も低下します。
遊離残留塩素 と 結合残留塩素
飲料水の検査項目に「遊離残留塩素」があります。薬剤師国家試験でも衛生化学の範囲で必ずと言っていいほど出てくる内容でもあるので、薬学生の方々も押さえておくと良いでしょう💡
遊離残留塩素
学校保健で定められている遊離残留塩素濃度は、水道法を参考に以下のような規定があります。
給水栓における水が、遊離残留塩素を 0.1 mg/L(結合残留塩素の場合は、0.4 mg/L) 以上保持するように塩素消毒をすること。ただし、供給する水が病原生物に著しく汚染されるおそれがある場合又は病原生物に汚染されたことを疑わせるような生物若しくは物質を多量に含むおそれがある場合の給水栓における水の遊離残留塩素は、0.2 mg/L(結合残留塩素の場合は、1.5 mg/L)以上とする。
水道法施行規則第17条
塩素は、アミン類との反応で生じるクロラミンの異臭といった問題もあるため、遊離残留塩素の濃度は1mg/L以下が望ましいとされています。
またWHOの報告では、人体に有害となるほどの残留塩素は通常の飲料水程度では問題ないとされており、最大値としては5mg/Lと設定されています。
ここで、遊離残留塩素は次亜塩素酸の分子形とイオン形(HClOとClO−)であり、結合残留塩素はクロラミン(NHxCly)を表しています。配管の老朽化や損傷によってアンモニア(NH3)などの“汚れ“が混入した場合は、(★)式で生成したHClOが結合残留塩素の生成反応に消費されることとなり、殺菌・消毒力も低下した状態となります。
化学反応式では以下のように表されます。
HClO + NH3 ⇄ NH2Cl + H2O (pH6.5以上(8.5で最大))・・①
HClO + NH2Cl ⇄ NHCl2 + H2O (pH5.0〜6.5)・・②
HClO + NHCl2 ⇄ NCl3 + H2O (pH4.4以下)・・③
これらの反応式からもわかるように、遊離残留塩素と結合残留塩素はpHに依存した平衡の関係ですが、殺菌・消毒力を維持するためには定められている残留塩素量が必要となります。
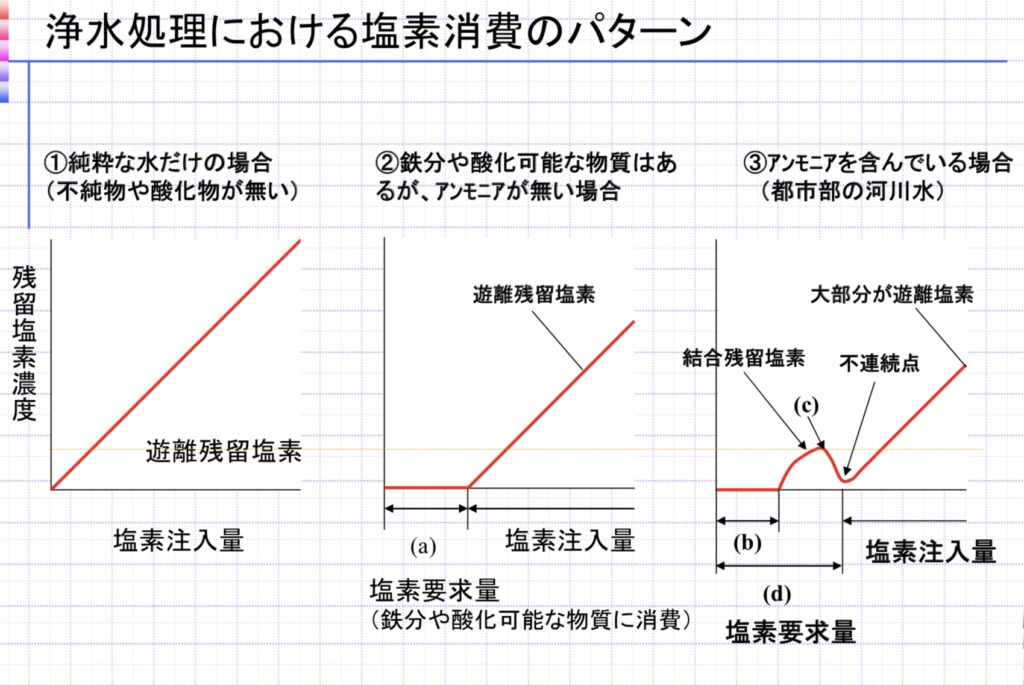
※「汚れ」には、アンモニア(NH3)やタンパク質(アミノ酸:–NH2)、アミン類(クロラミンなど)、その他有機物があり、これらは土壌中の含窒素化合物や死骸の分解によって生成します(生物学でも習いますね)。これらが老朽化した配管を通して侵入することで、配管中の残留塩素と反応することになります。場合によってはトリハロメタン(土壌中のフミン質が原因)が生成し、特にクロロホルム(CHCl3)は肝・腎毒性や発癌性が認められるため0.1mg/L以下でなければならないとする基準も設けられており、井戸水や河川水などを水源(原水)とする場合は特に重要な検査項目です。
結合残留塩素
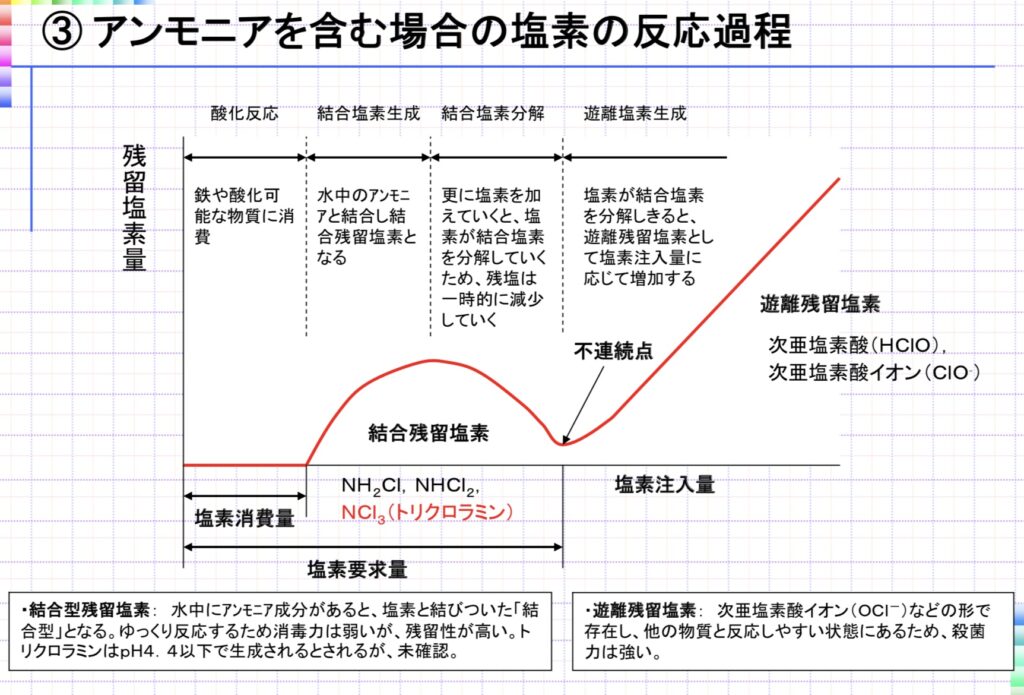
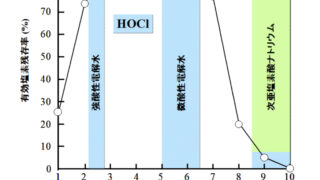
アンモニアを含む時の残留塩素量の変化は、結合型が増え、窒素が除去された後は減少、不連続点を超えると次第に遊離型が増加、といったパターンになります。(この不連続点を塩素要求量とも言います)
結合残留塩素が分解していく(有効塩素が消費されていく)過程の化学反応式は、
NH2Cl + NHCl2 → N2 + 3HCl
2NH2Cl + HClO → N2 + 3HCl + H2O
2NH3 + 3HClO → N2 + 3HCl + 3H2O
で表され、無害な窒素として除去することが可能となります。①〜③の結合残留塩素の生成反応に加え、これらの反応が終結すると“汚れ“を除去できた状態、つまりグラフの不連続点の部分で、それ以降は遊離残留塩素が増加していきます。このように不連続点を超えて遊離残留塩素が出るようになるまで塩素注入することを不連続点塩素処理と言います。
塩素要求量を満たすことで配管内を殺菌し、かつ人体に有害となることなく良好な水質の水を大量に使用することができ、私たちの生活が守られています。
追記.その他の学校薬剤師業務
プール水検査や空気(CO2)検査についてもまとめているので、そちらの記事(学校薬剤師③〜プール水検査〜、学校薬剤師④前編〜空気(CO2)検査〜)も併せてご参照ください。