プラチナ(Pt: 白金 )
Pt( 白金 )は周期表の10族で、第4周期のNi(ニッケル)、第5周期のPd(パラジウム)に次ぐ第6周期のd–ブロック金属元素です。
Ptの酸化数0(単体)の電子配置の最外殻(という表現は正しくはないが..)は5d96s1で、電子2個を放出した5d86s0(酸化数+2)の酸化状態が一般的、Pt4+も比較的容易に生成し、Pt6+の酸化状態までとり得ます。
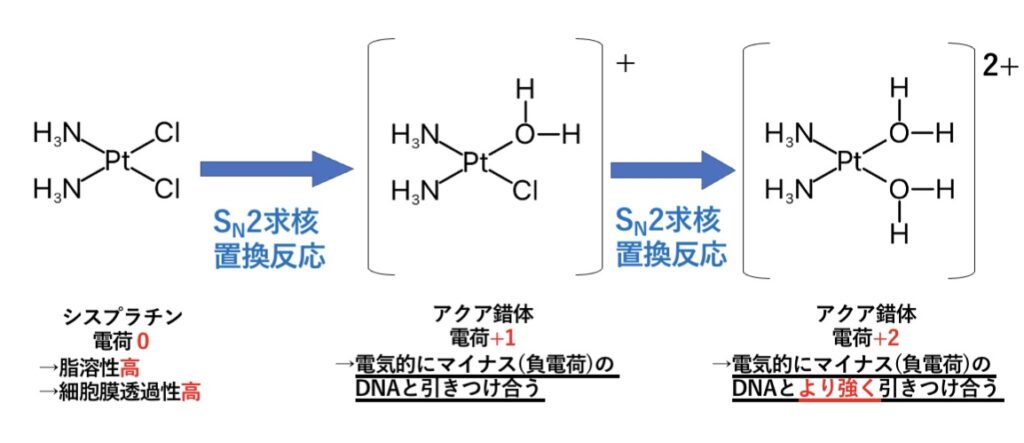
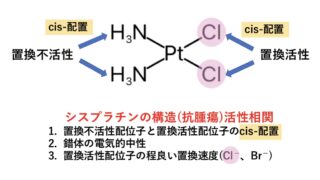
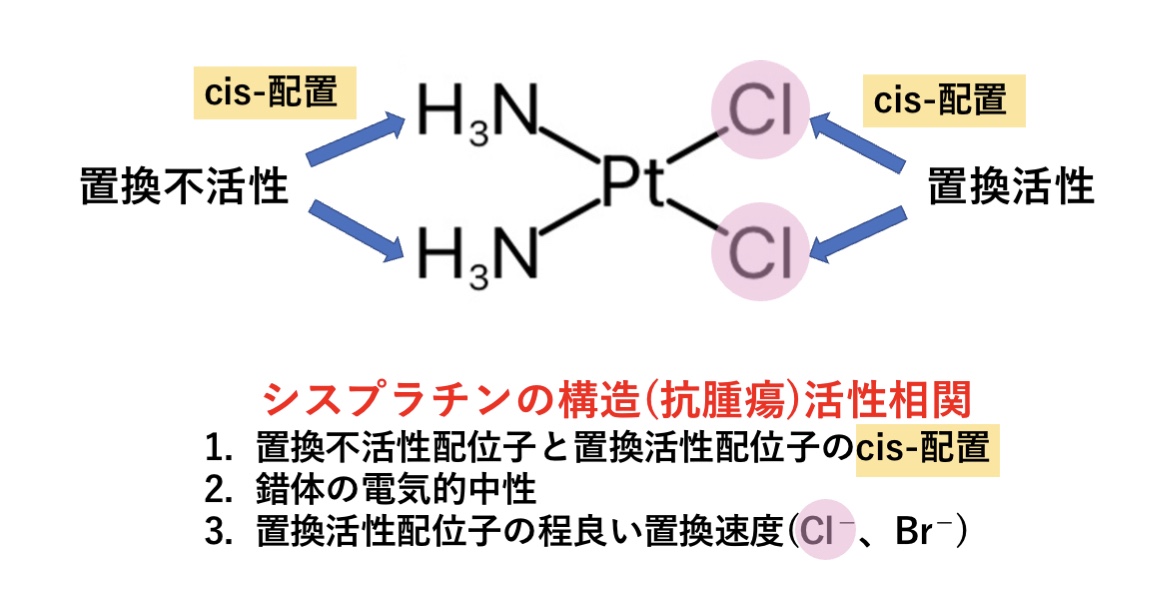
Pt2+の形成する錯体はほぼ例外なく平面四角形で、抗がん剤のシスプラチンの作用にもこの錯体の形が重要です。
Ptは周期表の第6周期で下の方に属し、Pt2+は*柔らかい酸のため、柔らかい塩基との相互作用は相性が良く共有結合性で安定化します。(シスプラチンではその薬効のためにも、配位子交換が早過ぎず遅過ぎずの特徴を持つような製剤設計がされている)
※硬い酸・塩基、柔らかい酸・塩基(HSAB則)については別の記事で解説する予定です。
一般的に、配位結合は配位子のローンペア(非共有電子対)を利用して金属イオンに結合するため、電子の授受で酸塩基反応を考えるルイス酸・塩基と捉えることができます。
硬い酸と硬い塩基、柔らかい酸と柔らかい塩基同士の相性は良く、結合が強力になります。(HOMO、LUMOなどのフロンティア軌道理論に基づく)
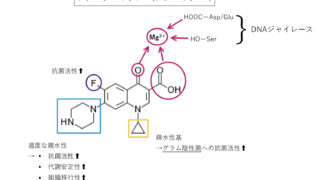
シスプラチン( 白金 製剤 )の構造活性相関
シスプラチンの構造活性相関(化学構造と薬理作用の関係)から、シスプラチンの抗腫瘍活性を増強させるための構造的特徴には以下のものがあります。
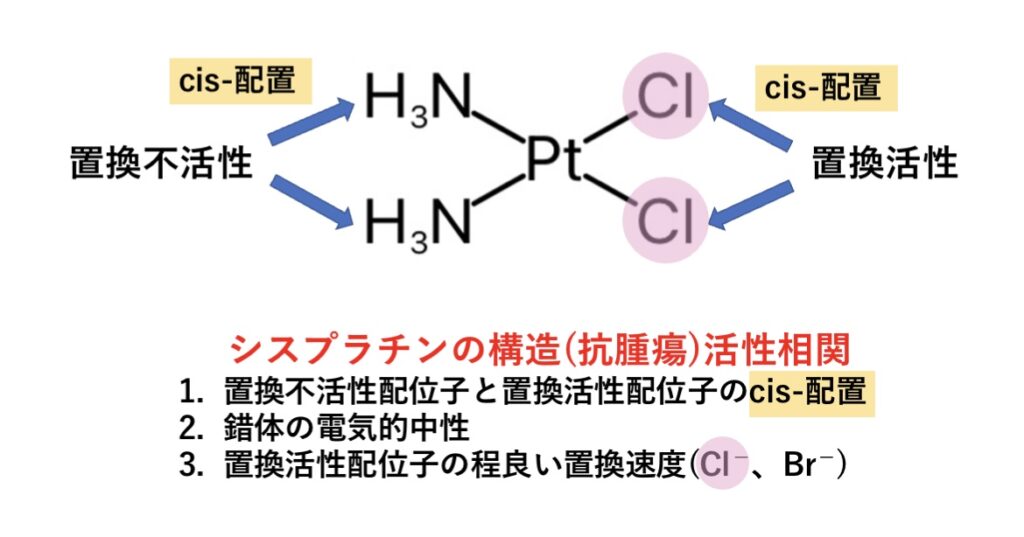
①置換不活性配位子と置換活性配位子のcis-配置
②錯体の電気的中性
③置換活性配位子の程良い置換速度(Cl−、Br−)
いずれの特徴も錯体・配位化学的な理由があるので、少し説明を加えます。
置換不活性配位子と置換活性配位子のcis-配置
シスプラチンは、cis-配置ではDNAの近接するグアニン(G)同士を架橋することができ、DNAの立体構造を変化させ、DNA複製阻害やアポトーシスの誘導作用を期待できます。
一方、trans-配置ではこのような抗腫瘍活性はほとんどなく、DNAを大きく歪め過ぎることでかえってDNA修復機構がはたらく可能性があるようです。
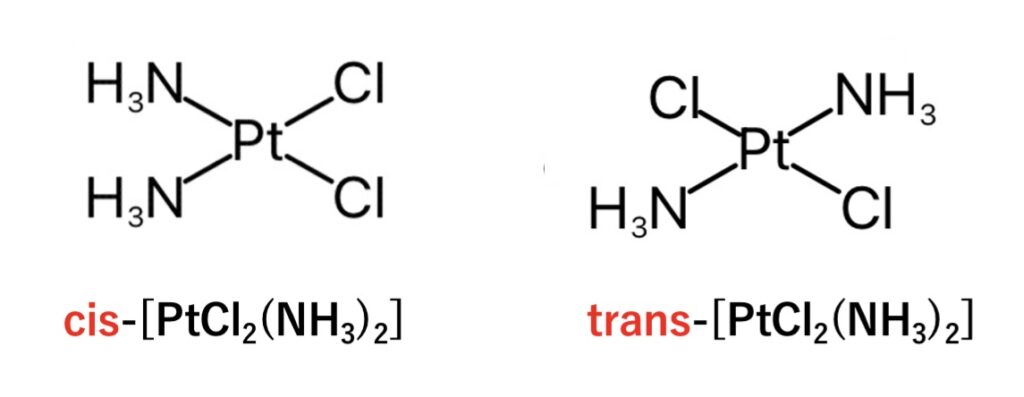
また、核酸塩基との架橋形成で配位するのは主にグアニン7位の窒素です。
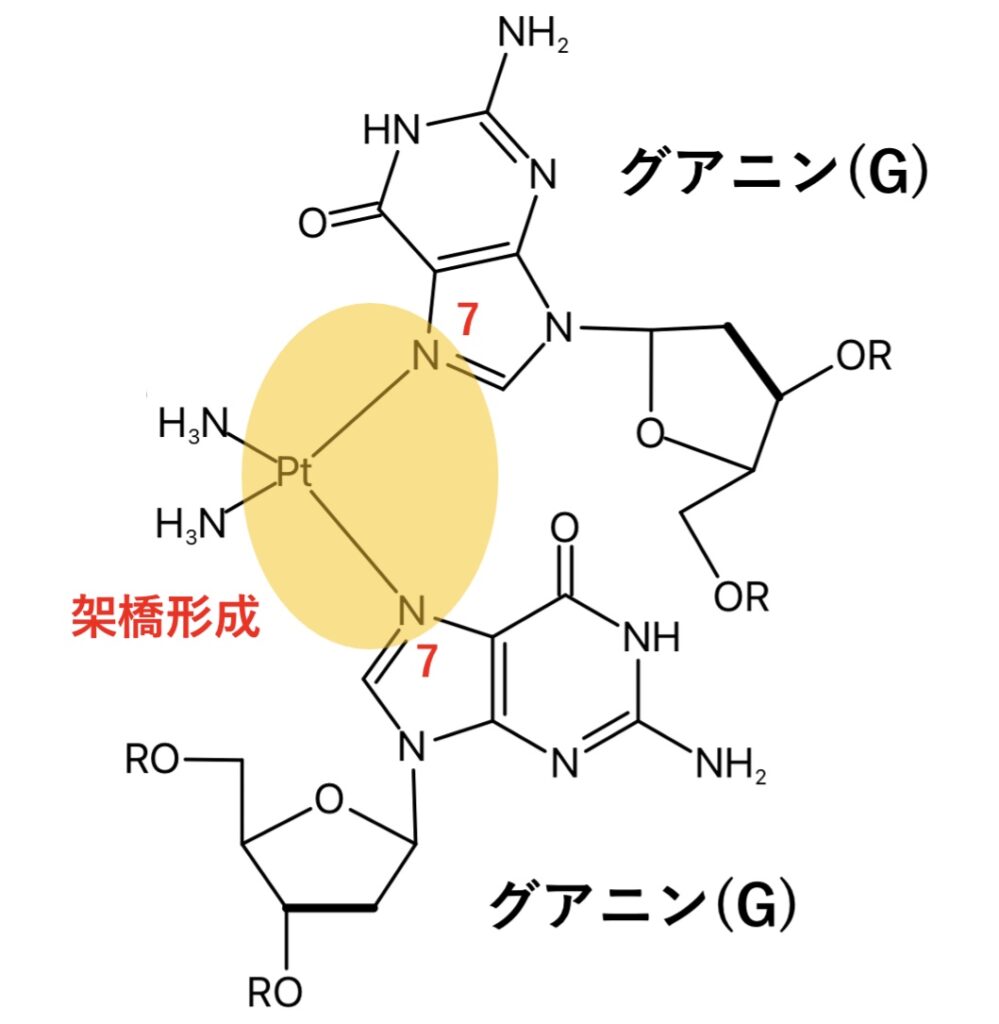
核酸塩基とシスプラチンの反応性は
グアニン(G)>アデニン(A)>>シトシン(C)>チミン(T)
とされ、多く(約60%)はDNA単一鎖内の隣接したG同士を架橋することで、抗腫瘍活性を発揮します。
錯体の電気的中性
有機化学でも通じるところの分子形・イオン形の脂溶性・水溶性の違いと同じで、錯体の電気的中性はイオン形に比べ脂溶性が高い状態です。
シスプラチンが抗腫瘍活性(抗がん作用)を発揮するためには、シスプラチンが細胞内に移行し、核膜を通過後、DNAと相互作用しなければなりません。
そのため、シスプラチンは投与後に錯体として細胞膜を通過する必要性から、最初は脂溶性の高い電気的中性を保つ必要があります。
ここで、Cl–濃度は細胞外で高く、細胞内で低いことから、細胞膜通過後はH2O分子と配位子交換し、アクア錯体へ変換されます。