ニューキノロン系抗菌薬
ニューキノロン系抗菌薬 は細菌のⅡ型トポイソメラーゼに作用し、DNAの複製を阻害することで抗菌活性を示す薬剤ですが、サブタイプがありⅡAとⅡBに分けられます。
ⅡAは細菌、真核生物、ⅡBは古細菌、植物、マラリア原虫に存在しており、細菌に存在するⅡ型トポイソメラーゼにはDNAジャイレースとトポイソメラーゼⅣがあります。(余談ですが、真核生物のトポイソメラーぜⅡは抗がん剤の標的酵素となっています。)
それぞれ、DNA複製時に重要な酵素ですが、ニューキノロン系抗菌薬は、もともとDNAジャイレースに対する親和性が高くグラム陰性菌に活性があり、世代が進むに連れてトポイソメラーゼⅣに対する親和性が高まり、グラム陽性菌へスペクトルを広げ抗菌活性も高めていきました。
今回の記事で構造を確認するのは、とりわけ普段よく出てくる(?)ような薬剤で、それぞれの世代は、
シプロフロキサシン(シプロキサン®︎)→第二世代
レボフロキサシン(クラビット®︎)→第三世代
モキシフロキサシン(アベロックス®︎)、ガレノキサシン(ジェニナック®︎)、シタフロキサシン(グレースビット®︎)→第四世代
といったカテゴリーになっています。
最も新しく上市されたラスクフロキサシン(ラスビック®︎)に関しては、情報があまりにも少ないため割愛致します。
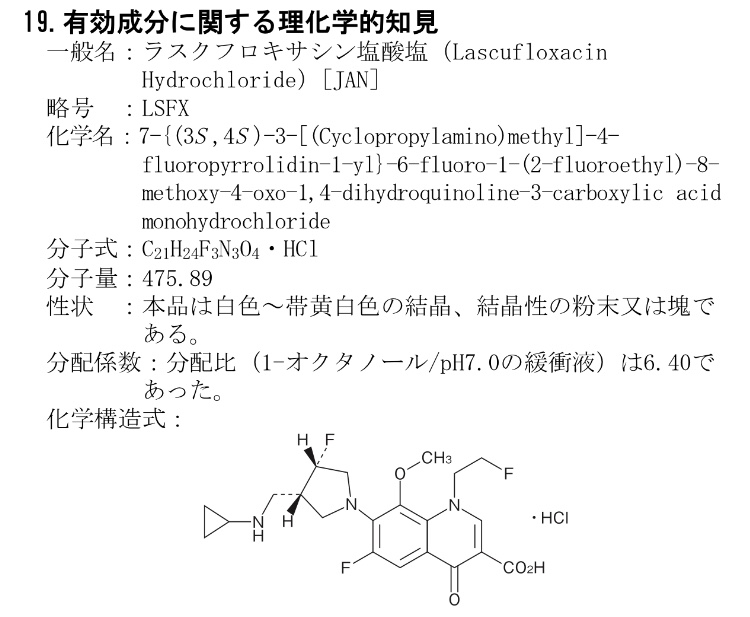
ニューキノロン系抗菌薬 の 構造活性相関
まずニューキノロン系抗菌薬の全般に共通した構造上の特性を確認すると、
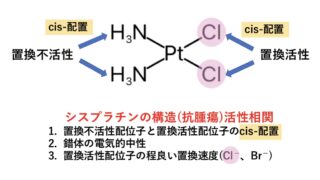
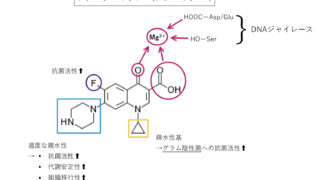
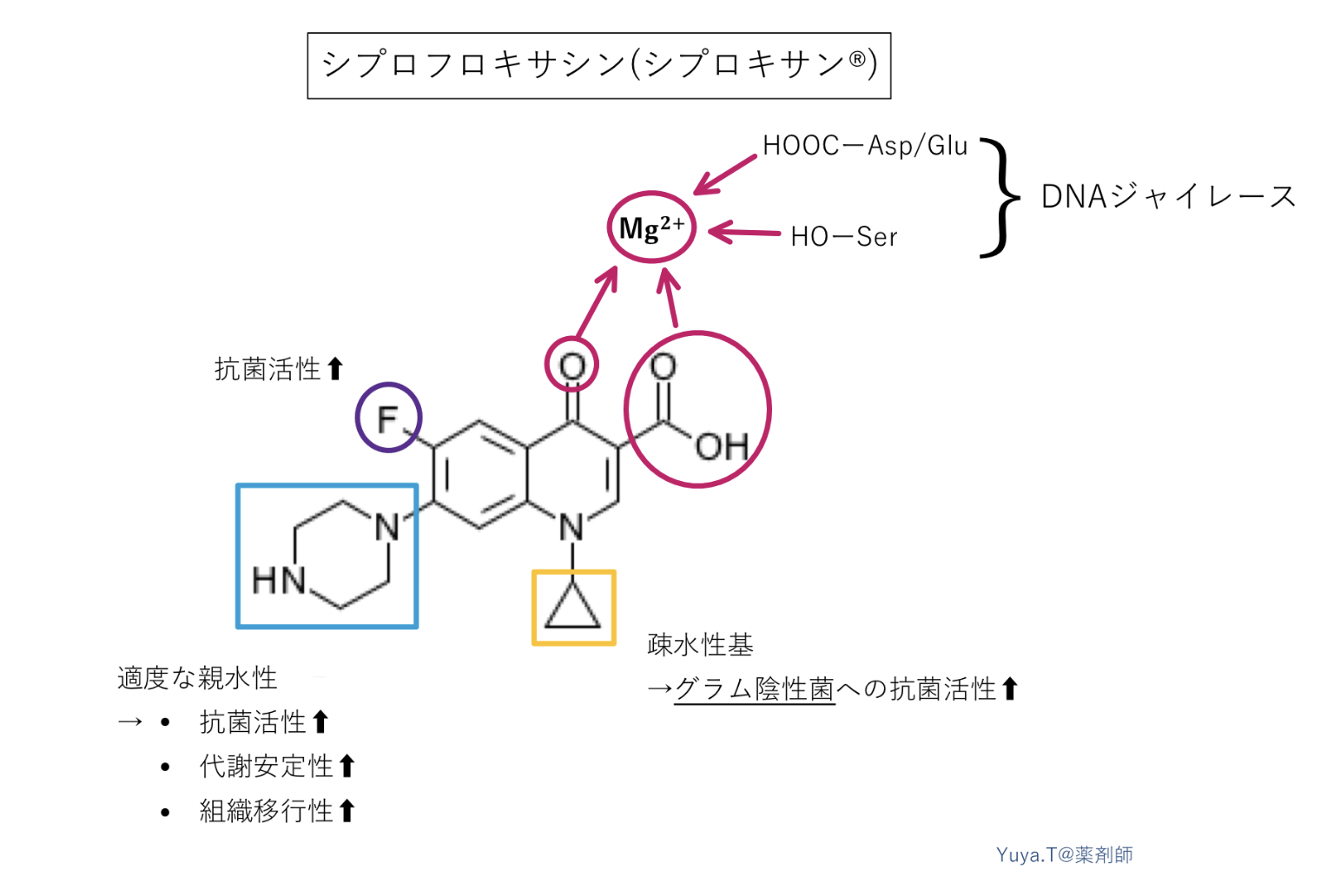
①キノリン環のカルボニル基(ーC=O)とカルボキシ基(ーCOOH)は、Mg2+を介してDNAジャイレースと複合体を形成。
→ニューキノロン系抗菌薬の多くは、添付文書の併用注意にMg2+を含む制酸薬と同時に服用しないように記載があるのも納得ですね。
②キノリン環6位のFが抗菌活性と組織移行性を向上。(例外 : ガレノキサシン)
などがあります。
シプロフロキサシン(シプロキサン®︎):CPFX
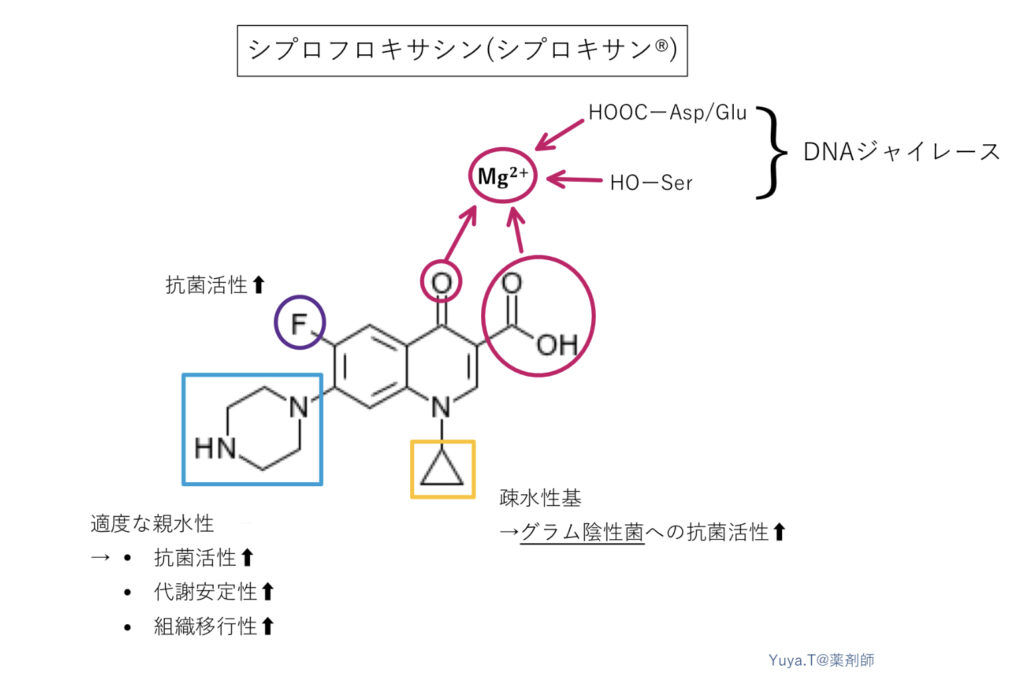
グラム陰性桿菌に活性が高く、緑膿菌を含む感染症治療に使われます。
レボフロキサシン(クラビット®︎):LVFX
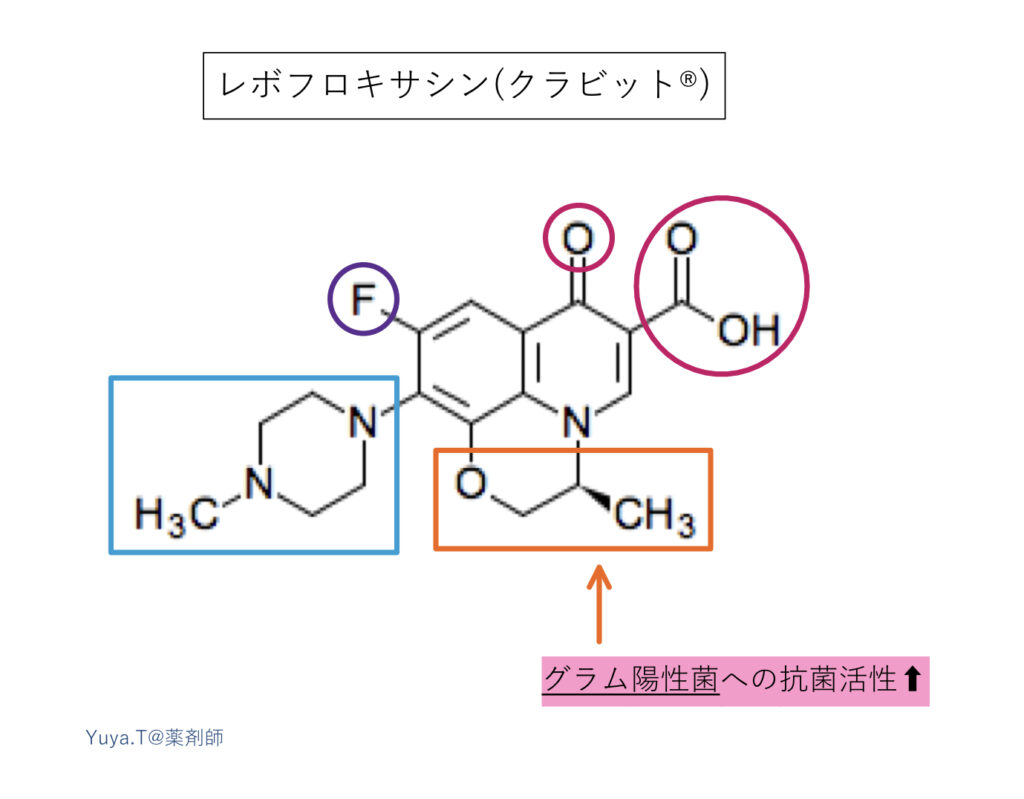
次のモキシフロキサシンで顕著ですが、8位にエーテルが加わると、トポイソメラーゼⅣへの阻害活性が向上し、グラム陽性菌への抗菌活性も増強されます。レボフロキサシン(S体)はラセミ体のオフロキサシン(タリビット®︎)に比べて活性が2倍で、かつ毒性が弱いのも特徴的です。さらにR体に比べ脂溶性が同等であるにもかかわらず水溶性は10倍近く高いことから、尿路等、全身組織への移行性も良好となっています。
モキシフロキサシン(アベロックス®︎):MFLX
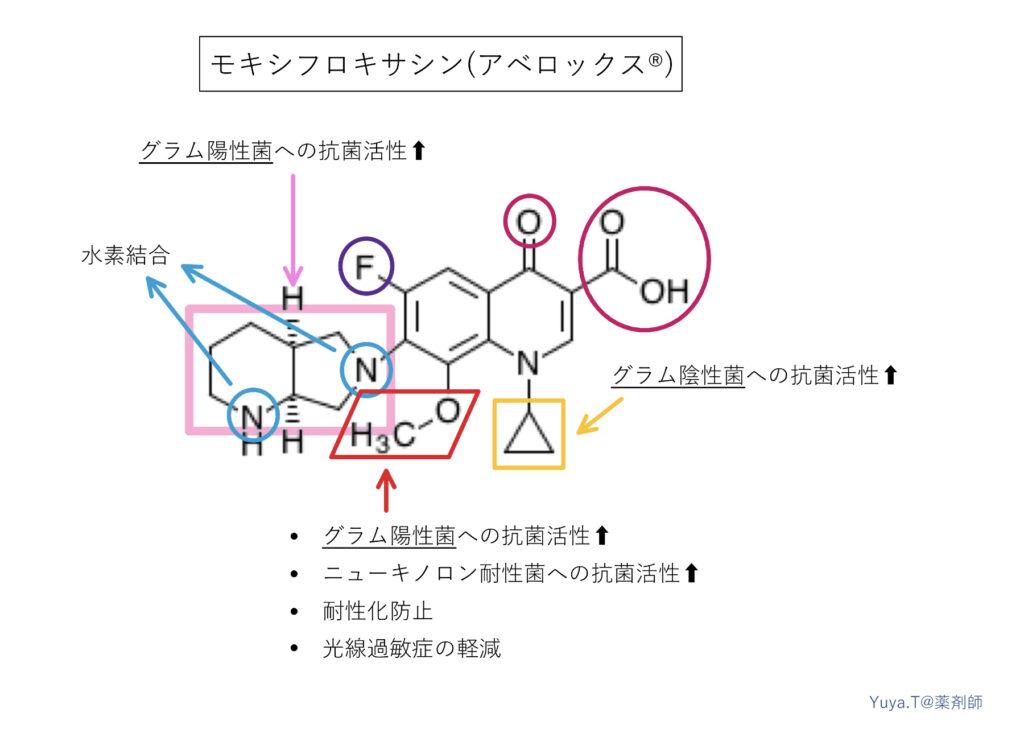
従来のニューキノロン系に比して、さらに強いトポイソメラーゼⅣ阻害作用を持ち、グラム陽性菌へのスペクトルと抗菌活性が増強されています。また、その脂溶性の高さから、肺組織への移行性も高く、レスピラトリーキノロンとして呼吸器感染でよく使われます。
ガレノキサシン(ジェニナック®︎):GRNX
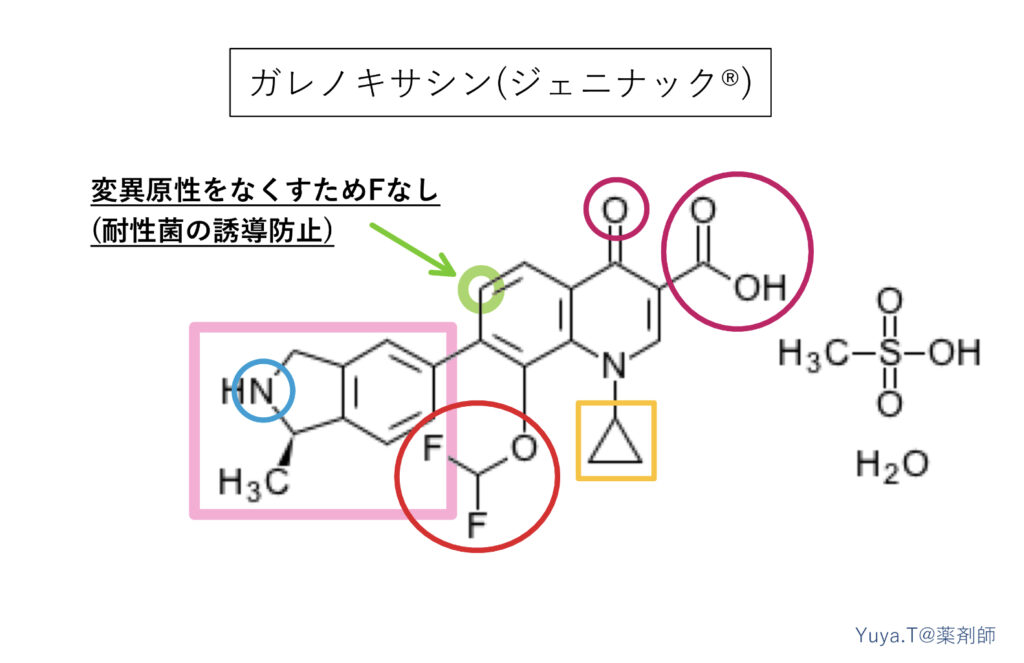
ガレノキサシンは他のニューキノロン系と違い6位にFが入っておらず、耐性菌を出現させにくくする狙いがあります。また、6位にFがなくても他の置換基によって高い抗菌活性を維持できるという特長も持っています。実際にレボフロキサシンに耐性をもつ菌に対しても強力な抗菌作用を持つとされていますが、ガレノキサシンの適応症はほぼ呼吸器系となっています。
シタフロキサシン(グレースビット®︎):STFX
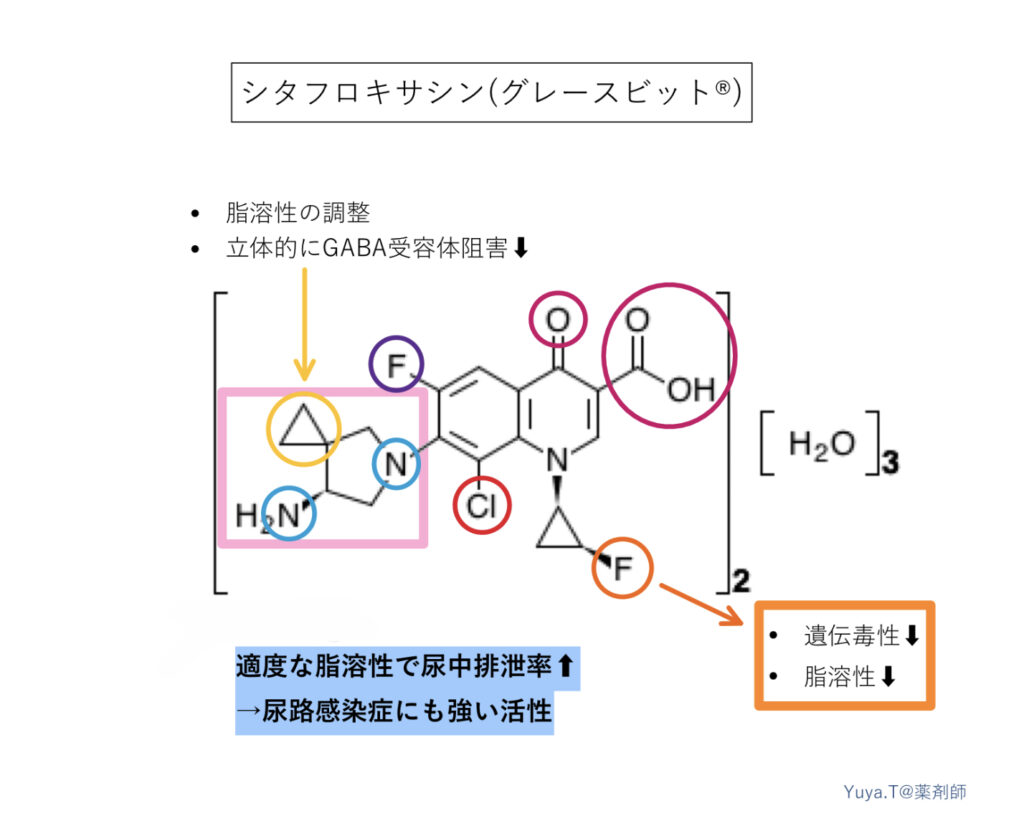
特徴は”適度な脂溶性”です。1位シクロプロパンのFと、7位ピロリジン環のシクロプロパンによって、脂溶性が絶妙に調整され尿中未変化体排泄率が向上し、尿路感染にも優れた効果を示します。耐性菌が出現しにくい構造設計でもあるようで、キノロン耐性菌にも強い抗菌活性を持つこともわかっています。また、従来のニューキノロンで問題になりやすいGABA受容体阻害作用も低減される構造のようです。
追記) ニューキノロン系抗菌薬 の 耐性化
ニューキノロン系に限った話ではないですが、やはり耐性菌の出現は問題となります。
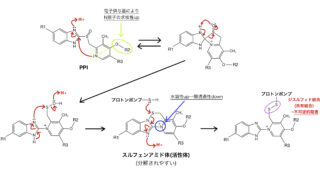
耐性化にはいくつか機構がありますが、その中でもDNAジャイレースのアミノ酸残基の変異は、キノロンーMg2+ーDNAジャイレース複合体の形成を妨げ、ニューキノロン系の酵素阻害効果を失わせます。特にDNAジャイレースのMg2+と結合するGlu/Asp残基やSer残基の変異が多く、これによりMg2+と適切に結合できなくなるようです。ニューキノロン系抗菌薬の阻害作用に必須であるキノロンのカルボニル基やカルボキシ基が無効化されては、そもそも抗菌活性を示せなくなり死活問題なので、医療者側の医薬品適正使用の意識の重要性も窺えます。
併せて読みたい記事
参考:
・Fluoroquinolone-gyrase-DNA complexes: two modes of drug binding. Arkady Mustaev, et al. J Biol Chem. 2014 May 2;289(18):12300-12. PMID: 24497635
・DNA Topoisomerase Inhibitors: Trapping a DNA-Cleaving Machine in Motion. Benjamin D Bax, et al. J Mol Biol. 2019 Aug 23;431(18):3427-3449. PMID: 31301408
・Quinolone-binding pocket of DNA gyrase: role of GyrB. Jonathan handle, Anthony Maxwel. Antimicrob Agents Chemother. 2002 Jun;46(6):1805-15. PMID: 12019094
・Role of the Water–Metal Ion Bridge in Mediating Interactions between Quinolones and Escherichia coli Topoisomerase IV. Katie Aldred, et al. Biochemistry 2014, 53, 34, 5558–5567.
・Crystal structure and stability of gyrase-fluoroquinolone cleaved complexes from Mycobacterium tuberculosis. Tim R Blower, et al. Proc Natl Acad Sci U S A. 2016 Feb 16;113(7):1706-13. PMID: 26792525
・Structural Insights into the Quinolone Resistance Mechanism of Mycobacterium tuberculosis DNA Gyrase. Jeremie Piton, et al. PLoS One 2010; 5(8): e12245. PMID: 20805881
・Fluoroquinolone interactions with Mycobacterium tuberculosisgyrase: Enhancing drug activity against wild-type and resistant gyrase. Katie J Aldred, et al. Proc Natl Acad Sci U S A. 2016 Feb 16; 113(7): E839–E846. PMID: 26792518
・https://www.jstage.jst.go.jp/article/medchem/22/2/22_24/_pdf