P糖タンパク質 (P–gp)
P糖タンパク質 はpermeabilitiy(膜透過)glycoprotein(糖タンパク質)の略でCYP以外での薬物相互作用の代表格の一つです。
P–gpは薬物を体外に排出させる、つまり体内に異物(毒物)を取り込まないようにするための防御機構の一つで、ATPの加水分解エネルギーを利用して細胞外に薬物を排出します。
MDR1(Multidrug Resistance 1)やABCB1(ATP-binding cassette B member 1)などの呼び方もあります。
P–gpは、脳、筋、乳腺、肺、肝臓、膵臓、小腸、副腎、腎臓、精巣、卵巣、血液ー組織関門(脳、胎盤)など、全身の組織・器官に発現しており、特にがん細胞で高レベルに発現しているため、抗がん剤の治療抵抗性に影響し問題となっています。
添付文書でも併用禁忌や併用注意の項目にP-gpが理由の相互作用も記載されていますが、厳密な定義がなく、また他のトランスポーターとの重複やCYPほど相互作用への影響が少ない場合も多くあり、CYPのように相互作用の定量化には至っていないのが現状のようです。
P-gpの基質はCYP3A4とオーバーラップしやすいことも有名ですが、ファーマコフォアという点では、やはりまだまだ解明が進んでいるとは言えません。
この記事においてもCYPと同様に、P-gpの*基質と阻害の強さを、AUCに何倍の増減を与える可能性があるかを目安に、
5倍以上→「強い」
2〜5倍→「中程度」
1.25〜2倍→「弱い」
と分類して構造式を見てみます。
cf. https://www.ptweb.jp/images/asset/PT_DDI_2019_Jap_0219.pdf
*基質の相互作用の受けやすさ→強い阻害薬の併用によりAUCが何倍増減するか
阻害薬の強さ→相互作用を受けやすい基質薬のAUCを何倍に増減させるか
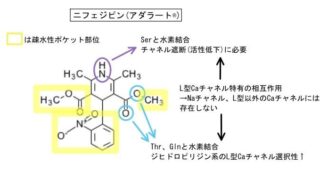
P–gpの基質の考え方はグレープフルーツジュースによるCYPへの影響とDHP系Ca拮抗薬の相互作用を考慮する上でも重要です。
P糖タンパク質 の構造
P–gpは膜貫通型のABC(ATP-binding cassette)トランスポーターで、相同な2つのタンパク質で構成され、それぞれに6つのヘリックスと1つのNBD(Nucleotide binding domain:ATP結合部位)を持ちます(A)(B)。
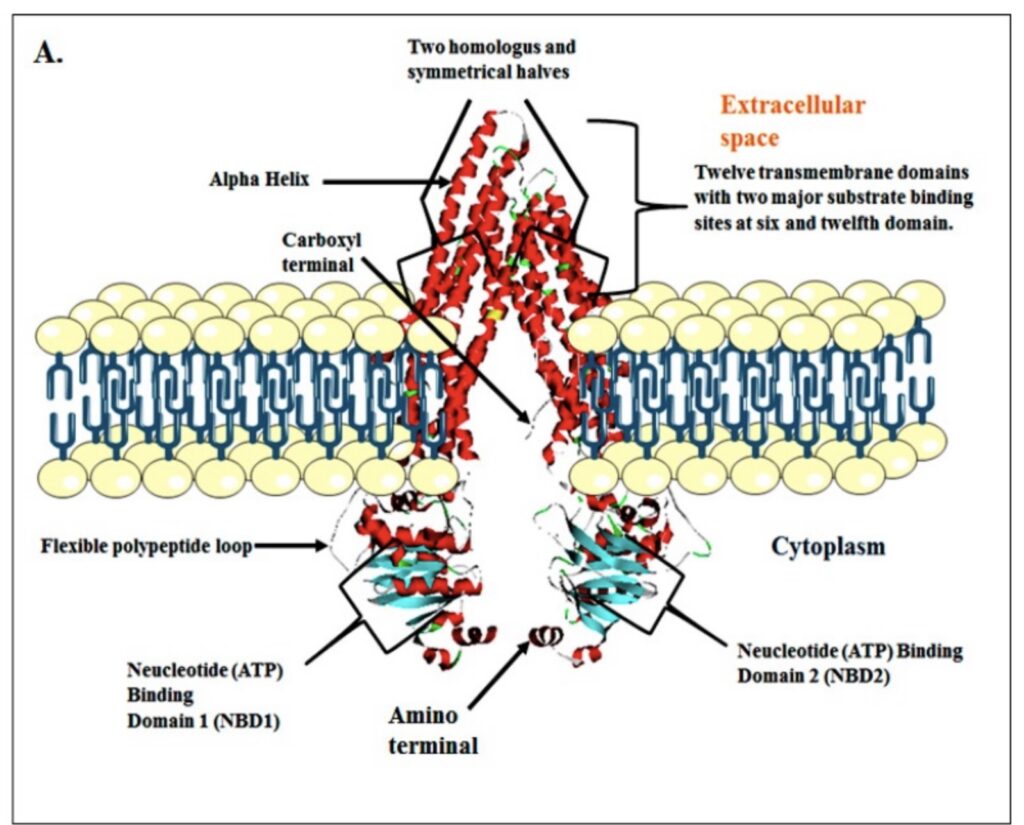
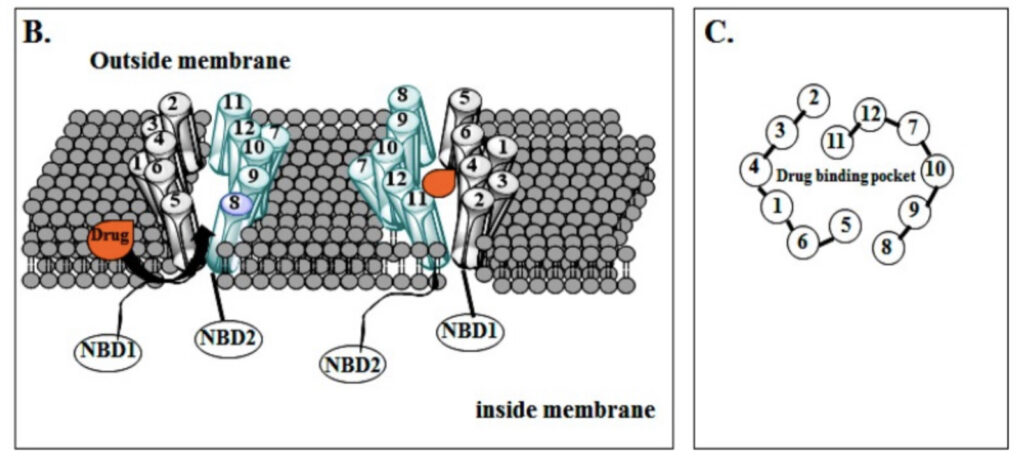
基質の結合部位は(B)(C)のような中心部分にあり、ATPの加水分解エネルギーを利用して立体構造が変化し、薬物が細胞外へ排出される仕組みとなっています。
薬物排出機構のステップは以下の通り。
①薬物がP–gp中心部の結合サイトに結合(B)
②ATPがNBD(ATP結合部位)に結合
③ATPを利用した二量体化による構造変化
④細胞外ドメインが開き薬物を細胞外へ排出
また、P-gpの薬物結合サイトは研究によっていくつか見つかっているものの、それによる基質特異性の違いは現在のところ不明です。
P糖タンパク質 の基質と阻害薬の構造活性相関
基質には基本的に疎水性の高いものがなりやすく、少し細かく特徴を見ると、程よい極性、高い疎水性(logP>5)、芳香環を持つ分子が基質になりやすいようです。
阻害には、基質と同じ「嵩高さ、高い疎水性」に加え、アルキル(アリル)エーテル、脂肪族3級アミン構造を持つと阻害作用を示す可能性が高まるようです。
(この構造解析モデルの精度は基質/非基質で70%、阻害/非阻害が75%とされ、これらの構造的特徴に合致すればそれくらいの確率でP–gpの基質、阻害作用の有無を推測できる可能性を持ちます)
いずれにしてもP–gpの基質特異性の低さは未だに不明な部分が多く、ファーマコフォアの全容も明らかになっていません。
あくまで“傾向“であってご参考までに。
① P糖タンパク質 の基質
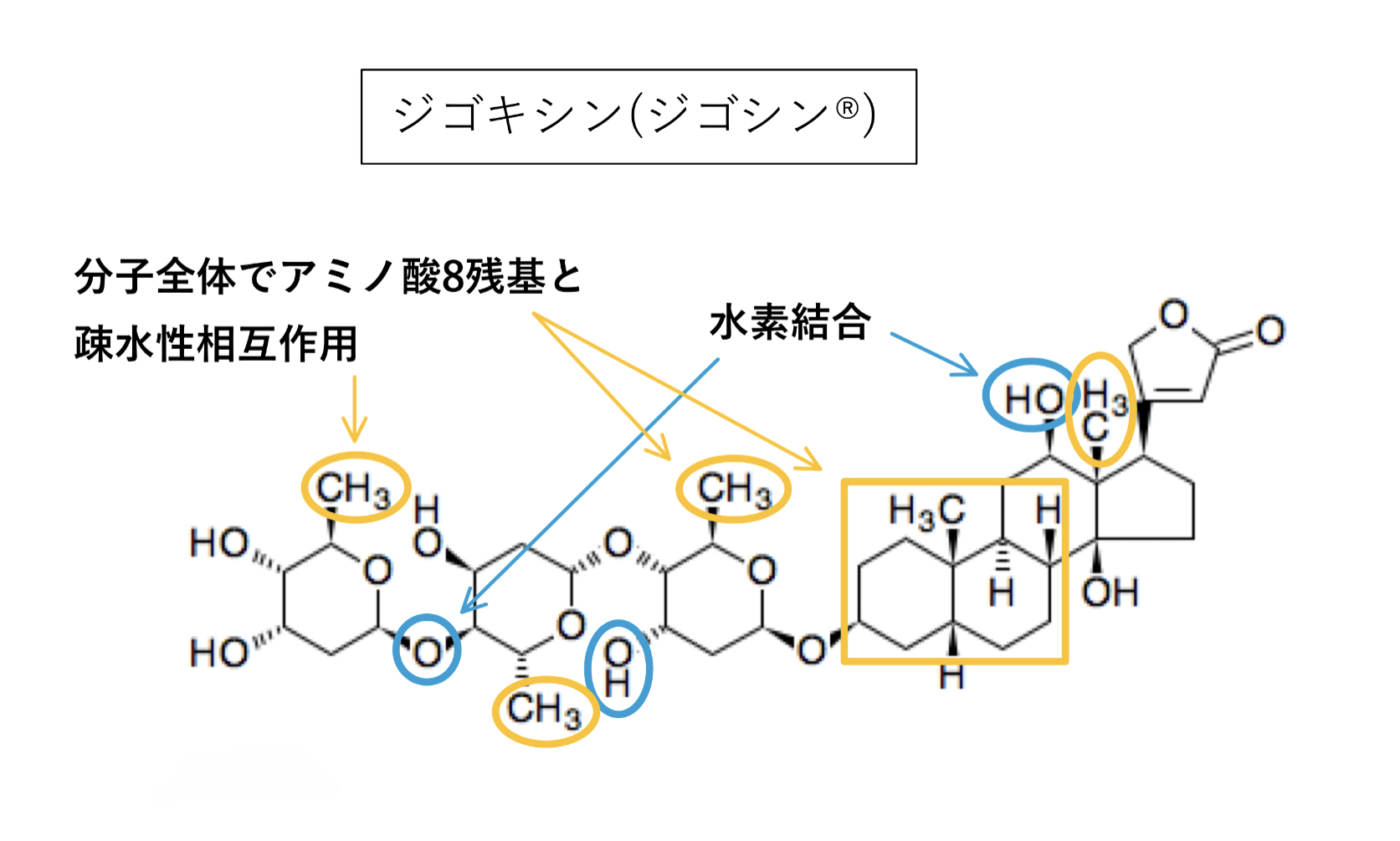
ジゴキシン
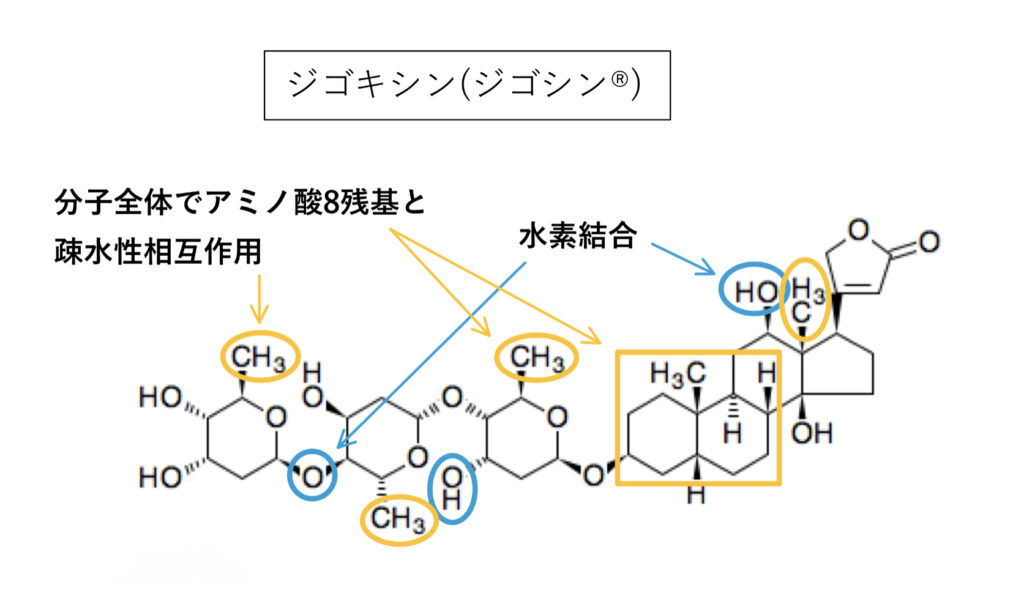
典型基質の一つでP–gp相互作用を評価する際に使われる基質薬でもあります。
P-gpとは疎水性相互作用と分子内O原子による水素結合が主。
Km73〜177μM(厚労省資料)で基質としての親和性も高いことが分かっており、logPは該当資料なし(IF)、強い阻害薬併用による影響の受けやすさは「中程度」となっています。
ロペラミド
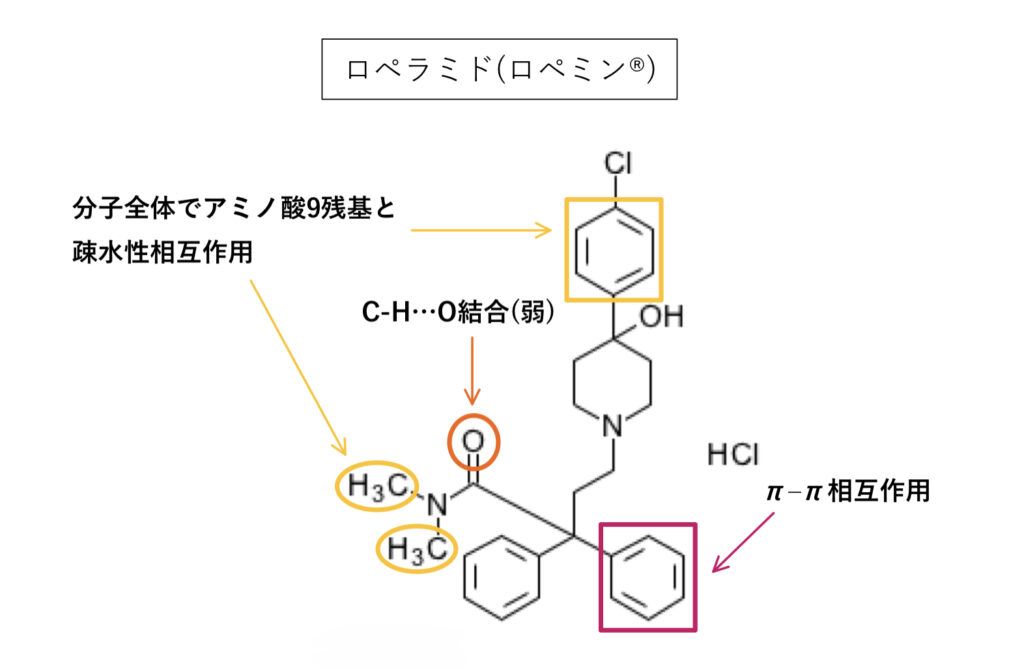
基質としてP-gpとの親和性が高いことがわかっており(Km1.8〜5.5μM:厚労省資料)、条件が揃ってないので一概には言えないものの数値的にはジゴキシンよりも親和性が高そうです。
芳香環含めた疎水性相互作用に弱い水素結合、3級アミンもあり、logPは該当資料なしで基質として影響の受けやすさは「中程度」のようです。
ドキソルビシン
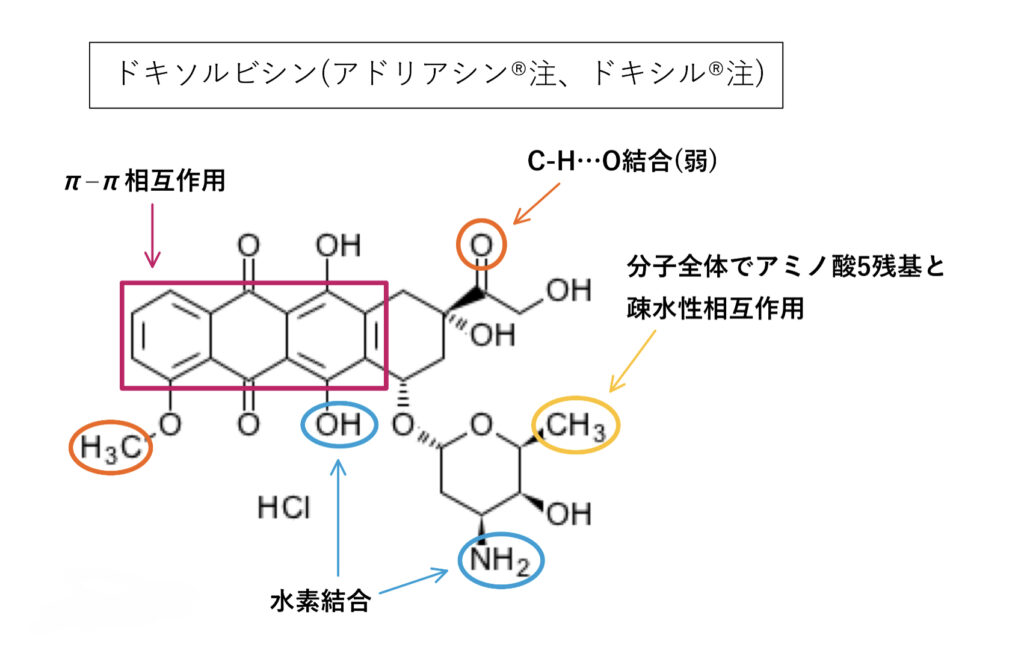
構造解析では基質としての報告がありますが、IFなどの資料ではlogPやトランスポーターなどの該当項目がありません。
分子的に見れば疎水性相互作用や水素結合を含み基質である可能性はありますが、相互作用ありと評価されなかったのは臨床上問題にならない程度と言えそうです。
パクリタキセル
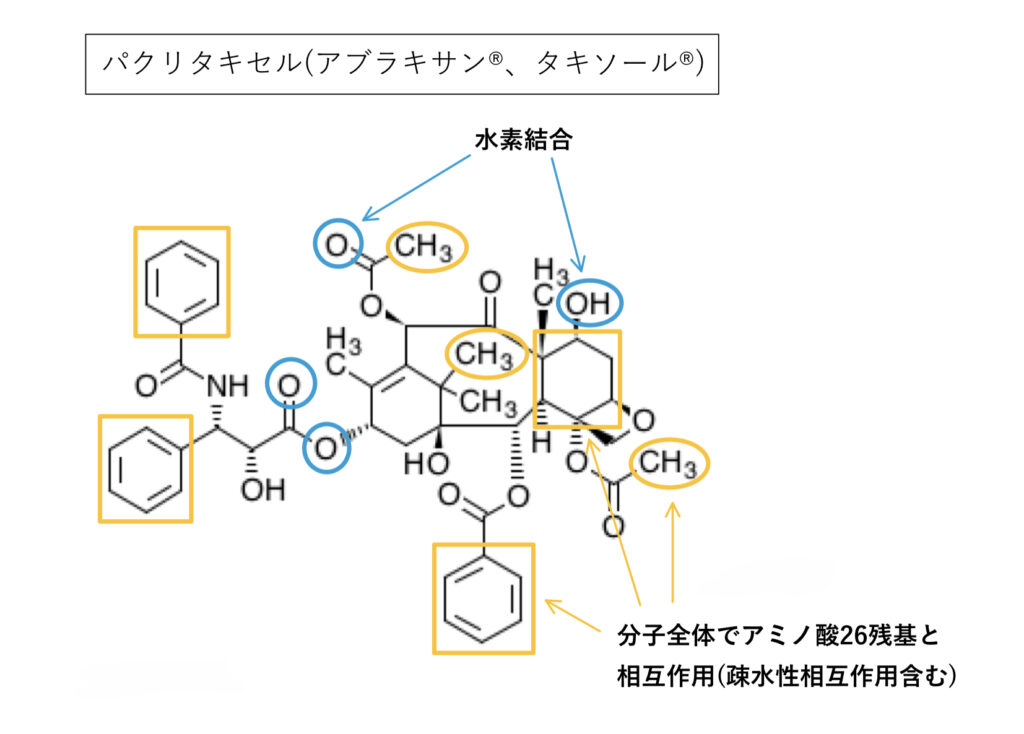
logPの該当資料なしですが、基質としての影響の受けやすさは「中程度」とされています。
芳香環を含む疎水性相互作用が分子全体で26残基と多いのも特徴です。
ただしアミノ酸3残基と水素結合するもののP–gpによる排出機構に必須ではなく、結合部位における疎水性相互作用が安定化に大きく寄与しているようです。
② P糖タンパク質 の阻害薬
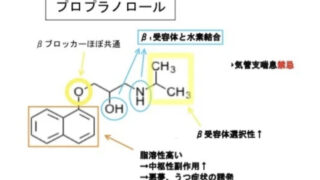
アミオダロン
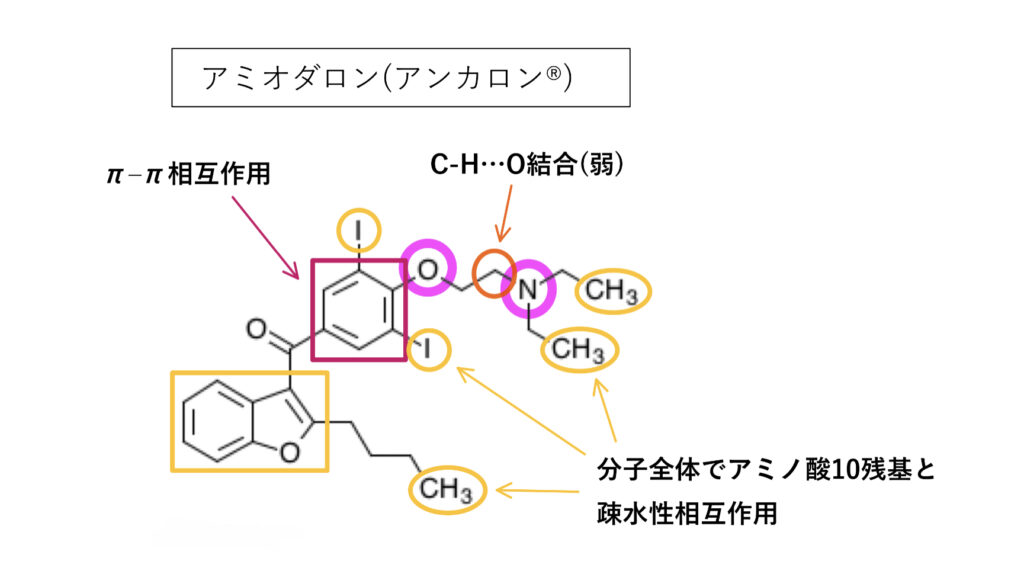
P-gp阻害作用はin vivoでも認められています。
アミオダロンはlogP>5と疎水性の高い分子で、芳香環、疎水性相互作用、脂肪族3級アミン、アルキルエーテルなど、P-gp阻害薬が持つ特徴を網羅した構造となっています。
③ P糖タンパク質 の基質+阻害薬
シクロスポリン
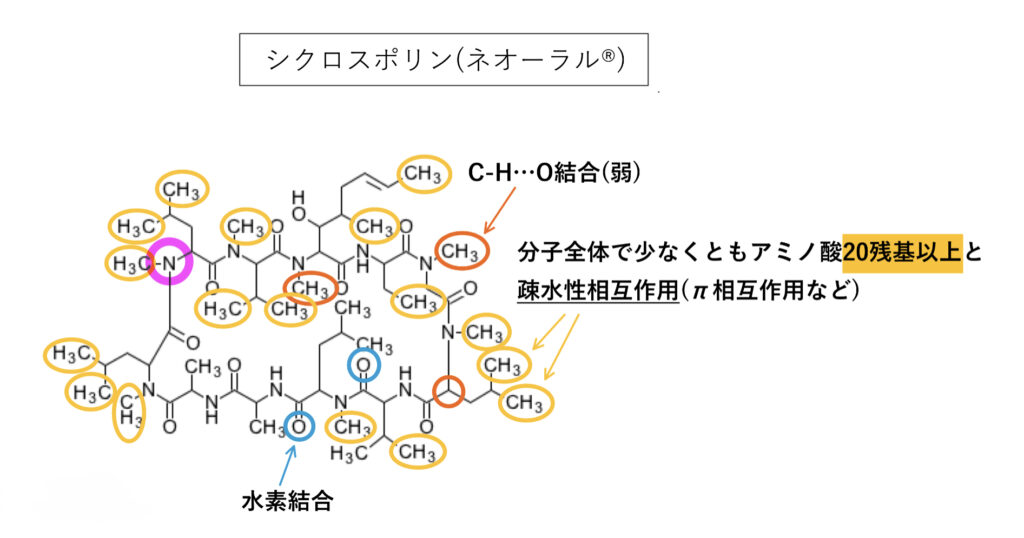
多くの疎水性相互作用と3級アミン構造を持ち、分子量が大きくlogP=2.92と疎水性も高めです。
P-gpの「弱い基質」であり「中程度の阻害作用」があります。Ki(IC50)0.5〜2.2μMと阻害薬としても高い親和性を持っています。
ベラパミル
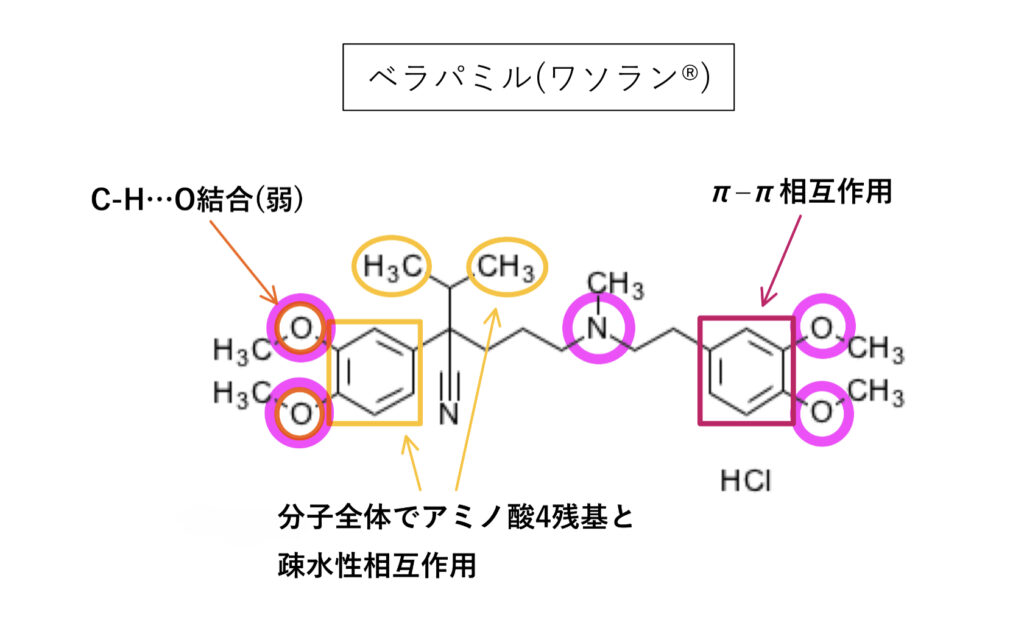
阻害薬としての構造的特徴を比較的押さえているのがわかります。
logPは該当資料なし。Ki(IC50)は2.1〜33.5μMでシクロスポリンほどの阻害活性はなく、「弱い基質」「弱い阻害作用」を持ちます。
カルベジロール
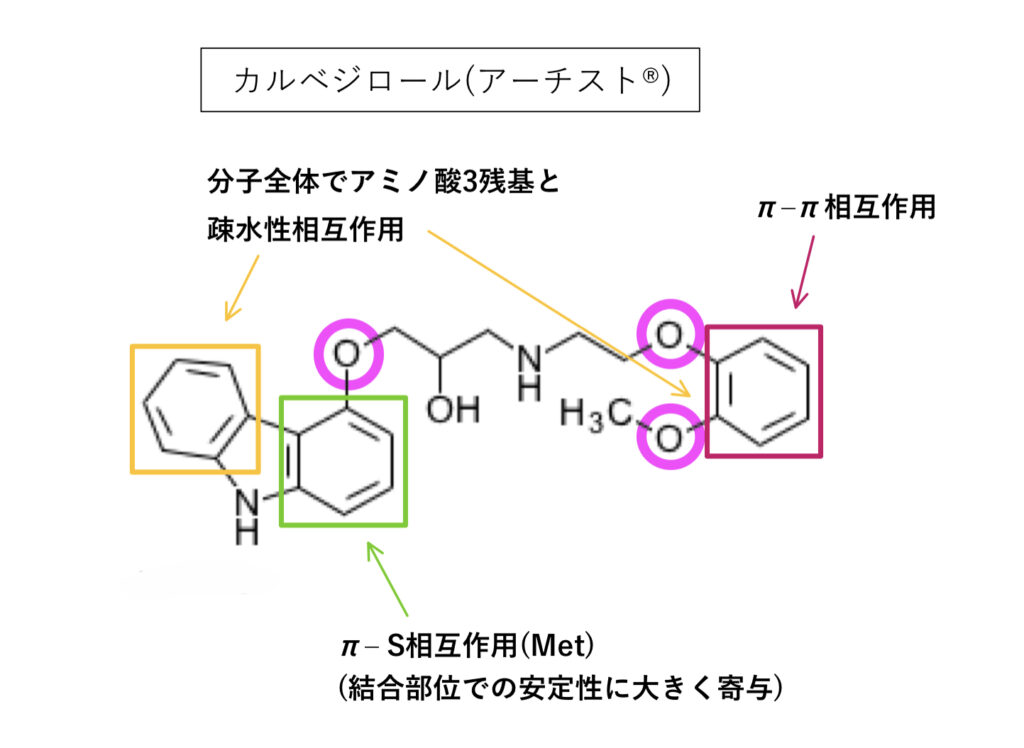
芳香環が疎水性相互作用し、アルキルエーテル構造を持ちlogPは約2.3。
構造解析結果としては基質として十分可能性があり、実際に阻害作用も認められているようです(添付文書に記載はない)。
最後に
P-gpはまだまだ不明な点が多く臨床における評価も難しいトランスポーターの一つですが、構造解析技術が発展し、だんだんと構造活性相関やファーマコフォアが見えてきているのも事実です。
P–gpの基質や阻害薬はCYP3A4でも同様の重なりが多いことから、少なくとも両者の結合部位には高い類似性があることが予想できますが、現状で有力なデータを発見することはできませんでした。
いずれにしても生体に異物が蓄積しないようにするために必要な機構で、一般的に細胞内へ移行し蓄積する可能性の高い、脂溶性の高い物質がターゲットになるのも理解できます。
P–gpの基質薬や阻害薬になりやすい構造
・高い脂溶性(logP>5)
・脂肪族3級アミン
・六員環(芳香環)
・アルキル(アリル)エーテル
を構造に含む場合が多いようです。
もちろんこれらに当てはまらないものも多く存在すると思いますが、創薬の観点からも、P-gpとの相互作用を回避するための知見として重要であることは間違いないでしょう。
ただ残念ながら、今回の結果からは構造的特徴と基質・阻害の『強さの程度』までは考察できませんでした。今後、研究が進むにつれて徐々に明らかになってくると思われます。
そして臨床的にも、P-gpの基質になりやすい薬剤をP-gp阻害薬と併用することで、P-gpを発現する臓器で蓄積性が増して本来ならあまり心配の要らない副作用が現れるリスクがあります。
単に血中濃度の上昇に留まらず特定臓器での組織移行率が変化する可能性があり、例えば血液-脳関門のP-gpが阻害されると中枢性の副作用リスクに注意を払う度合いも高まります。
こうしたトランスポーターを介した薬物相互作用も複雑さを極めますが、がん細胞におけるP-gpのアップレギュレーションなど、治療抵抗性にも深く関わるので、いずれ構造化学的にも解明されることを期待しています。
コラム) ロペラミド(ロペミン®︎)で呼吸抑制?
ロペラミド(ロペミン®︎)は消化管のオピオイドμ受容体を刺激し消化管運動を抑制することで止瀉作用を示します。
ロペラミドはP-gpの基質であり、通常であれば消化管だけでなく血液-脳関門からもP-gpによって排出されるため中枢抑制の副作用の心配はほとんどありません。
しかしキニジンなどのP-gp阻害薬を併用すると、ロペラミド過量投与時の症状として添付文書にも記載があるように、鎮静・呼吸抑制など中枢作用の出る可能性が高まります。
実はロペラミドにはモルヒネなどのオピオイドに共通する化学構造があるため、消化管のオピオイドμ受容体に作用できます。
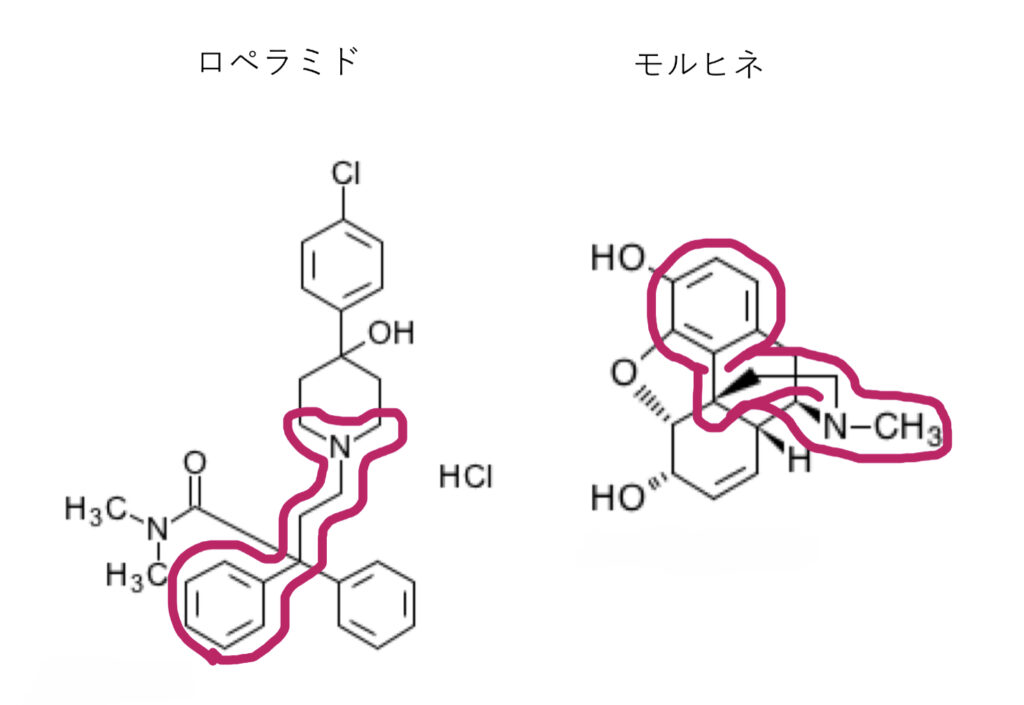
よって、本来であれば消化管のμ受容体に作用し、吸収されても血液-脳関門のP-gpで排出されるロペラミドがP-gp阻害薬により脳内移行性が高まると、オピオイドの中枢作用である鎮静・呼吸抑制等を引き起こす可能性が高まるというわけです。
ロペラミドの過量投与時の解毒薬が、モルヒネの解毒に使われる「ナロキソン」であることも納得ですね!
あわせて読みたい記事
参考:
・Stephen G. Aller, et al. Structure of P-glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 2009 Mar 27; 323(5922): 1718-1722. PMID: 19325113
・Deepali Waghray and Qinghai Zhang. Inhibit or Evade Multidrug Resistance P-glycoprotein in Cancer Treatment. J Med Chem. 2018 Jun 28; 61(12): 5108-5121. PMID: 29251920
・Saikat Dewanjee, et al. Natural Products as Alternative Choices for P-Glycoprotein (P-gp) Inhibition. Molecules. 2017 Jun; 22(6): 871. PMID: 28587082
・Freya Klepsch, et al. Ligand and Structure-Based Classification Models for Prediction of P-Glycoprotein Inhibitors. J Chem Inf Model. 2014 Jan 27; 54(1): 218–229. PMID: 24050383
・Zsolt Bikadi, et al. Predicting P-Glycoprotein-Mediated Drug Transport Based On Support Vector Machine and Three-Dimensional Crystal Structure of P-glycoprotein. PLoS One. 2011; 6(10): e25815. PMID: 21991360
・Jerónimo Laiolo, et al. Structure activity relationships and the binding mode of quinolinone-pyrimidine hybrids as reversal agents of multidrug resistance mediated by P-gp. Sci Rep. 2021; 11: 16856. PMID: 34413359
・Liadys Mora Lagares, et al. Homology Modeling of the Human P-glycoprotein (ABCB1) and Insights into Ligand Binding through Molecular Docking Studies. Int J Mol Sci. 2020 Jun; 21(11): 4058. PMID: 32517082
・James W. McCormick, et al. Multiple Drug Transport Pathways through human P-Glycoprotein. Biochemistry. 2015 Jul 21; 54(28): 4374-4390. PMID: 26125482
・Vasanthanathan Poongavanam, et al. Fingerprint-based in silico models for the prediction of P-glycoprotein substrates and inhibitors. Bioorg Med Chem. 2012 Sep 15; 20(18): 5388–5395. PMID: 22595422
・Keerthana Sasitharan et al. ABCB1 Does Not Require the Side-Chain Hydrogen-Bond Donors Gln 347, Gln 725, Gln 990 to Confer Cellular Resistance to the Anticancer Drug Taxol. Int J Mol Sci. 2021. PMID: 34445264
・医薬品開発と適正な情報提供のための薬物相互作用ガイドライン(最終案)、平成26年7月8日、厚生労働省医薬・生活衛生局医薬品審査管理課
・医療現場における薬物相互作用 へのかかわり方ガイド、編集:日本医療薬学会 医療薬学学術第一小委員会
・各種添付文書、IF